{{ variable.name }}
【藥品名稱】
通用名:艾美賽珠單抗注射液
商品名:舒友立樂
【生產企業】
ChugaiPharma Manufacturing Co., Ltd
【成份】
活性成份:艾美賽珠單抗
艾美賽珠單抗是一種修飾的人源化IgG4單克隆抗體,通過重組DNA技術在中國倉鼠卵巢(CHO)細胞中製備,該抗體具有雙特異性抗體結構,可橋接凝血因子IXa和凝血因子X。賦形劑:L-精氨酸,L-組氨酸,L-天冬氨酸,泊洛沙姆188。
【適應症】
本品適用於存在凝血因子VIII抑制物的A型血友病(先天性凝血因子VIII缺乏)成人和兒童患者的常規預防性治療以防止出血或降低出血發生的頻率。
【規格】
30mg(1ml)/瓶
60mg(0.4ml)/瓶
105mg(0.7ml)/瓶
150mg(1ml)/瓶。
【用法用量】
概述
本品應在有血友病和/或出血疾病治療經驗的醫生指導下使用。
如需用其他生物製品替換,應事先獲得處方醫師同意。
開始本品治療前一天應中止旁路製劑治療(例如:凝血酶原複合物,活化重組人凝血因子VII)(參見【注意事項】)。
推薦劑量
最初4週的推薦劑量為3mg/kg每週一次(負荷劑量),隨後為1.5mg/kg每週一次(維持劑量),通過皮下注射給藥。
治療過程中的劑量調整
不建議對本品進行劑量調整。
遺漏用藥
如果沒有在預定日期注射本品,則在下一個計劃給藥日期前盡快給藥,然後恢復常規的每週給藥計劃。不得增加劑量來彌補遺漏用藥。
特殊人群
1. 兒童
不建議對兒童患者進行劑量調整(參見【兒童用藥】)。
2. 老年人
不建議對≥65歲患者進行劑量調整(參見【老年用藥】)。
3. 腎功能損傷和肝功能損傷
不建議在輕度腎功能損傷或者輕、中度肝功能損傷患者中進行劑量調整。目前尚未在中、重度腎功能損傷或者重度肝功能損傷患者中對本品進行過研究。
給藥方法
本品僅用於皮下給藥,應在醫療專業人員的指導下使用本品。經過充分規範的皮下注射技術培訓並經醫生許可後,患者可自行注射本品或由照料者進行注射給藥。不建議7歲以下兒童自行給藥。
每次注射應選擇與前一次注射不同的部位(可選擇的注射區域參見說明書文末使用說明)。不可在有痣、疤痕或者皮膚壓痛、淤青、發紅、發硬或破損的區域進行注射。本品在上臂外側給藥只能由照料者或醫療人員進行。本品治療過程中,其他皮下注射藥品最好選擇不同的解剖部位進行注射。
使用、操作和處置的特殊說明
本品為無菌溶液,不含防腐劑,無需稀釋,可直接皮下注射。
本品為無色至淺黃色溶液。給藥前應當目視檢查,確保溶液中不含微粒或變色,否則應丟棄。
本品注射液藥瓶僅供一次性使用。
需採用注射器、移液針和注射針抽出瓶中的本品溶液,然後進行皮下給藥。
本品溶液注射體積不超過1mL時應採用1mL注射器,注射體積為1mL至2mL溶液時應採用2~3mL注射器。如果本品處方劑量對應的溶液體積超過2mL,需分次注射。
若處方劑量需要同時抽取多支藥瓶中藥品,請勿將不同濃度的艾美賽珠單抗注射液混合使用。
本品不含任何抗菌防腐劑,一旦將藥品從藥瓶轉移至注射器中,應立即使用。
本說明書文末附有具體的使用說明,注射器、移液針和注射針的選擇,操作前準備,注射部位的選擇和準備,注射準備及操作示意以及注射後需注意相關內容詳見使用說明。
【不良反應】
臨床試驗
由於各臨床試驗間差異很大,因此一種藥物在臨床試驗中觀察到的不良反應發生率,不能與另一種藥物在臨床試驗中的發生率直接比較,也可能無法反映臨床實踐中觀察到的發生率。
以下不良反應(ADR)根據一項隨機試驗(HAVEN1)、一項單臂試驗(HAVEN2)和一項劑量探索試驗的匯總數據總結。共189例男性A型血友病患者接受至少一劑艾美賽珠單抗常規預防治療,其中94例(50%)成年人患者(≥18歲),38例(20%)青少年患者(≥12~<18歲),55例(29%)兒童患者(≥2~<12歲),2例(1%)嬰兒(1個月~<2歲)。
189例安全性人群中7例(4%)患者來自劑量探索試驗的FVIII抑制物陰性患者。所有研究的中位暴露時間為38週(範圍:0.8~177.2週)。
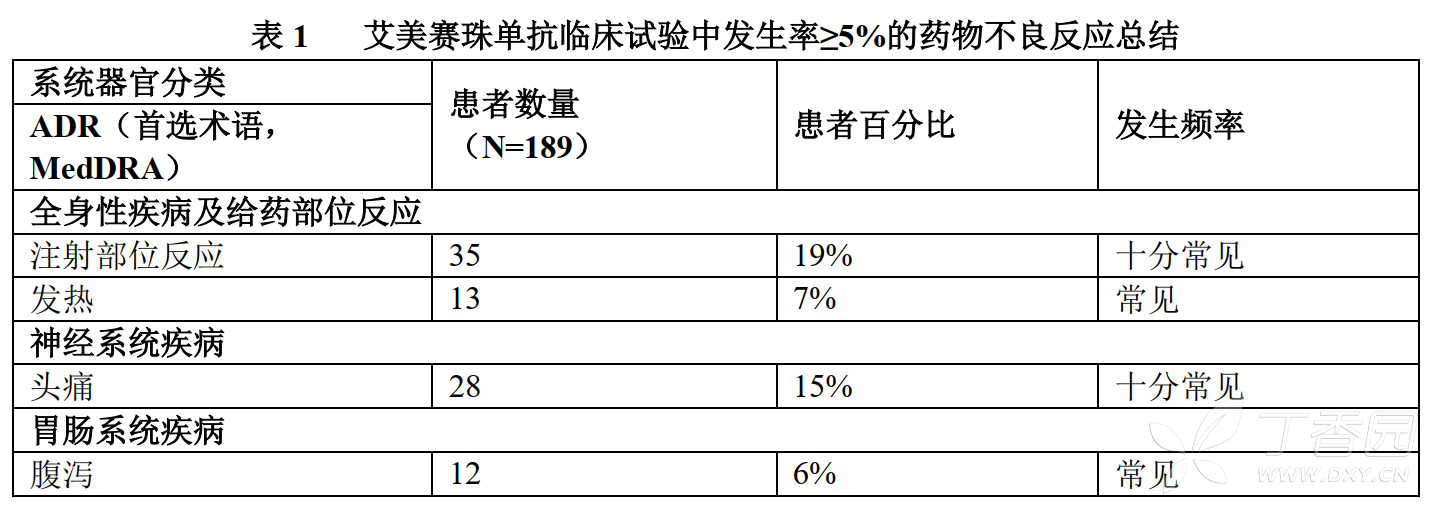
在接受至少一劑艾美賽珠單抗治療的患者中,觀察到的發生率≥10%的最常見ADR是注射部位反應、頭痛和關節痛。
臨床試驗中,共4例(2.1%)接受艾美賽珠單抗預防治療的患者因ADR(血栓性微血管病,皮膚壞死及淺表性血栓性靜脈炎,注射部位反應)退出治療。
下文表1按MedDRA系統器官分類列出臨床試驗中接受艾美賽珠單抗治療患者出現的藥物不良反應。各ADR的發生頻率採用以下分類方式:十分常見(≥1/10),常見(≥1/100至<1/10),以及偶見(≥1/1,000至<1/100)。
特殊藥物不良反應描述
艾美賽珠單抗在臨床試驗中報告的最嚴重藥物不良反應為血栓性微血管病(TMA)(共3例)和血栓形成事件(包括海綿竇血栓形成和淺表靜脈血栓形成伴皮膚壞死各1例)(參見【注意事項】)。
血栓性微血管病
臨床試驗中,血栓性微血管事件(TMA)的整體發生率為1.6%(3/189),在艾美賽珠單抗治療期間接受至少一次活化凝血酶原複合物(aPCC)治療的患者中發生率為8.3%(3/36)。據報告,3例TMA事件(表現為血小板減少、微血管病溶血性貧血和急性腎功能損傷,未出現 ADAMTS13活性重度缺乏)發生前,患者均在艾美賽珠單抗預防治療期間接受了24小時或更長時間的aPCC治療,且平均累積用量˃100 U/kg/24小時。其中1例患者在TMA緩解後重新開始艾美賽珠單抗治療(參見【注意事項】)。
血栓形成事件
臨床試驗中,嚴重血栓形成事件的整體發生率為1.1%(2/189),在艾美賽珠單抗治療期間接受至少一次aPCC治療的患者中發生率為5.6%(2/36)。據報告,2例患者出現血栓形成事件前,在艾美賽珠單抗預防治療期間均接受了24小時或更長時間的aPCC治療,且平均累積用量˃100 U/kg/24小時。其中1例患者在事件緩解後重新開始艾美賽珠單抗治療(參見【注意事項】)。
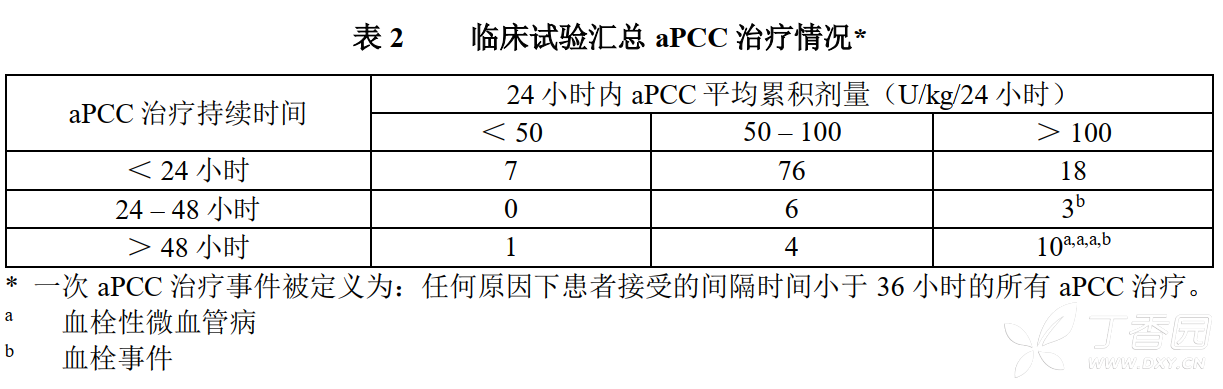
臨床試驗匯總aPCC 治療情況
共36例患者經歷125次aPCC治療事件,其中13次治療事件(10.4%)中aPCC的平均累計劑量超過100 U/kg/24小時,持續24小時或以上;這13次治療事件中,有2次與血栓事件有關,3次與TMA相關(表2)。其餘aPCC治療事件均與TMA或血栓事件無關。
注射部位反應
總共有35名患者(19%)報告了注射部位反應(ISR)。臨床試驗中觀察到的所有ISR嚴重程度為輕度至中度,88%未經治療即恢復。常見的ISR症狀是注射部位紅斑(7.4%)、注射部位瘙癢(5.3%)和注射部位疼痛(5.3%)。
橫紋肌溶解
兩名成年患者報告了橫紋肌溶解,伴有無症狀性血清肌酸激酶升高,不伴有相關的腎臟和肌肉骨骼症狀。這兩名患者的事件均在運動增加之後發生。
免疫原性
與所有治療性蛋白相同,艾美賽珠單抗治療可能誘發免疫應答。參與艾美賽珠單抗臨床試驗的少數患者檢測到抗藥物抗體(ADA),包括影響單抗活性的ADA。 ADA的出現可能與療效喪失有關,對安全性沒有明顯的臨床影響。 HAVEN1和HAVEN2兩項研究中(n=171)無受試者檢測到抗艾美賽珠單抗抗體陽性。劑量探索研究(ACE002JP)中(n=18)有4例受試者檢測到抗艾美賽珠單抗抗體陽性,均為非中和性抗體。
上述研究採用酶聯免疫吸附法(ELISA)進行抗艾美賽珠單抗抗體檢測。免疫原性測定結果可能受多種因素的影響,包括測定敏感性和特異性、樣本處理、樣本採集時間、合併用藥和基礎疾病。因此抗艾美賽珠單抗抗體陽性率可能並不適合與其他產品抗藥物抗體陽性率比較。
上市後經驗
無報告數據。
【禁忌】
本品禁用於已知對艾美賽珠單抗或任何輔料過敏的患者。
【注意事項】
概述
為提高生物製品的可追溯性,應在患者檔案中記明(或註明)藥品的商品名和批號。 在醫療機構以外進行本品給藥時,建議患者/照料者記錄藥品批號。
與艾美賽珠單抗和(活化) 凝血酶原複合物相關的血栓性微血管病
臨床試驗中,接受艾美賽珠單抗預防治療的同時,接受活化凝血酶原複合物(aPCC)治療24小時或更長時間且平均累積用量˃100U/kg/24小時的患者中,觀察到血栓性微血管病事件(TMA,參見【不良反應】項下臨床試驗)。 TMA事件的治療包括支持性治療,含或不含血漿置換和血液透析。終止aPCC給藥後一周即觀察到TMA改善,與非典型溶血性尿毒綜合徵和典型TMA(如血栓性血小板減少性紫癜)中所觀察到的常見臨床病程不同(參見【不良反應】項下臨床試驗)。
尚無艾美賽珠單抗預防治療期間接受凝血酶原複合物(PCC)治療的臨床經驗。基於兩者的作用機制和艾美賽珠單抗與aPCC合用的臨床經驗,推測艾美賽珠單抗預防治療期間接受PCC治療也將增加受試者發生血栓性微血管病的風險。
對於接受艾美賽珠單抗預防治療的患者,同時給予aPCC/PCC時應監測TMA的發生。如果臨床症狀和/或實驗室檢查結果提示發生TMA,醫生應立即終止aPCC/PCC使用,暫停艾美賽珠單抗治療,並根據臨床情況處理。醫生和患者/照料者應根據患者個人情況,在TMA完全緩解後權衡重新開始艾美賽珠單抗預防治療的獲益和風險。
應盡可能避免在艾美賽珠單抗預防治療期間接受aPCC或PCC治療,如果無法避免,請參見下文旁路製劑給藥的劑量推薦。如果患者存在高TMA風險因素(例如TMA既往病史或家族史)或者正在接受已知為TMA風險因素的合併用藥(例如環孢素、奎寧、他克莫司),接受本品預防治療時應謹慎用藥。
與艾美賽珠單抗和(活化)凝血酶原複合物相關的血栓栓塞事件
臨床試驗中,接受艾美賽珠單抗預防治療的同時,接受aPCC治療24小時或更長時間且平均累積用量˃100U/kg/24小時的患者中,觀察到血栓形成事件(參見【不良反應】項下臨床試驗)。所有病例均無須抗凝治療,這與常規血栓形成事件治療方法不同。終止aPCC治療後,血栓形成事件即改善或緩解(參見【不良反應】項下臨床試驗)。
尚無艾美賽珠單抗預防治療期間接受PCC治療的臨床經驗,推測艾美賽珠單抗預防治療期間接受PCC治療也將增加受試者發生血栓栓塞事件的風險。
對於接受艾美賽珠單抗預防治療的患者,同時給予aPCC/PCC時應監測血栓栓塞的發生。
如果臨床症狀、影像學檢查結果和/或實驗室檢查結果提示發生血栓形成事件,醫生應立即終止aPCC/PCC使用,暫停艾美賽珠單抗治療,並根據臨床情況處理。醫生和患者/照料者應根據患者個人情況,在血栓形成事件完全緩解後權衡重新開始艾美賽珠單抗預防治療的獲益和風險。
應盡可能避免在艾美賽珠單抗預防治療期間接受aPCC或PCC治療,如果無法避免,請參見下文旁路製劑給藥的劑量推薦。
接受艾美賽珠單抗預防治療患者使用旁路製劑的指南
開始艾美賽珠單抗治療前一天應終止旁路製劑治療。
接受艾美賽珠單抗預防治療前,應充分告知患者合併使用旁路製劑的可能性和風險。如果需要在艾美賽珠單抗預防治療的同時使用旁路製劑,醫生應與患者和/或照料者討論所用旁路製劑的準確劑量和給藥頻次。
艾美賽珠單抗可增加患者凝血功能。因此,需要的旁路製劑劑量可能低於未接受艾美賽珠單抗預防治療時的劑量。旁路製劑的劑量和治療持續時間也取決於患者的出血部位、程度,以及臨床狀況。
活化凝血酶原複合物(aPCC):除非沒有其他治療選擇,否則應避免使用aPCC。如果接受艾美賽珠單抗預防治療的患者需要aPCC治療,則起始劑量不得超過50U/kg,並應進行嚴密的實驗室監測(包括但不限於腎功能、血小板計數和血栓相關檢查)。如果起始劑量50U/kg的aPCC無法控制出血,應在醫學指導或監督下給予額外劑量的aPCC,但治療最初24小時內aPCC總劑量不得超過100U/kg。治療最初24小時內,需要的aPCC劑量如果高於最大劑量100 U/kg,主治醫生必須仔細權衡TMA、血栓栓塞風險和出血風險。
凝血酶原複合物(PCC):目前在臨床試驗和上市後環境中尚無艾美賽珠單抗與PCC合用的臨床經驗,應避免接受艾美賽珠單抗的患者同時接受PCC治療。如果PCC是患者唯一的可選擇治療,應前往專門的血友病治療中心接受治療,同時嚴密監測,注意有無血栓栓塞事件或血栓性微血管病的發生。
活化重組人FVII(rFVIIa):臨床試驗中,接受艾美賽珠單抗預防治療患者僅使用rFVIIa,未觀察到TMA或血栓形成事件。
終止艾美賽珠單抗預防治療後,應該遵循旁路製劑給藥的劑量指南至少6個月(參見【藥代動力學】,清除)。
影響實驗室凝血試驗結果
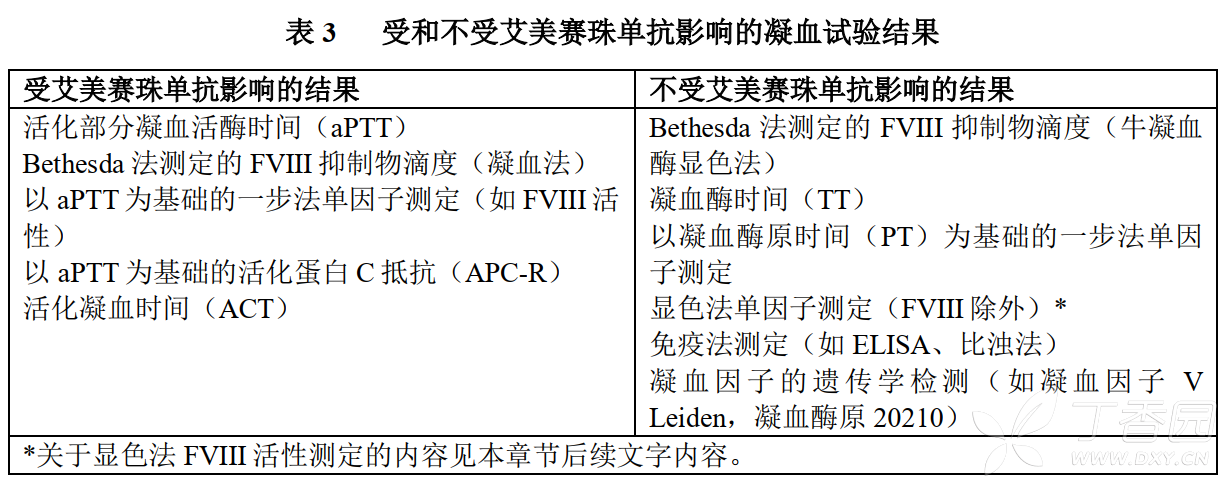
艾美賽珠單抗可恢復缺失的活化凝血因子VIII(FVIIIa)的tenase輔因子活性,因此會影響基於內源性凝血途徑的實驗室檢查,包括活化凝血時間(ACT)、活化部分凝血活酶時間(aPTT)測定結果,以及所有以aPTT為基礎的測定結果,如一步法凝血因子VIII活性測定(參見下文表3)。
因此,接受艾美賽珠單抗治療的患者,不可以依據基於內源性凝血途徑的實驗室檢查結果監測艾美賽珠單抗活性、確定凝血因子替代治療或抗凝劑劑量,或測定凝血因子VIII抑制物滴度。受艾美賽珠單抗影響和不受艾美賽珠單抗影響的實驗室檢查參見下文表3。
顯色法測定FVIII活性可採用人或牛凝血蛋白進行。含人凝血因子的測定方法受艾美賽珠單抗影響,可能高估艾美賽珠單抗的臨床止血效果。相反,含牛凝血因子的測定方法對艾美賽珠單抗不敏感(未測到活性),可用於監測內源性或輸注外源性FVIII的活性,或測定抗FVIII抑制物滴度。
存在FVIII抑制物的情況下,艾美賽珠單抗仍具有活性,所以在使用Bethesda凝血法測定FVIII抑制功能時,將產生假陰性結果。因此,可以採用牛血清Bethesda顯色法測定FVIII活性,該方法對艾美賽珠單抗不敏感。
由於艾美賽珠單抗的半衰期較長,以上對凝血試驗結果的影響可能最長持續至末次給藥後6個月(參見【藥代動力學】,清除)。
【藥物相互作用】
艾美賽珠單抗尚未進行充分或對照良好的藥物相互作用研究。
臨床經驗表明艾美賽珠單抗與aPCC之間存在藥物相互作用(見【注意事項】及【不良反應】項下臨床試驗)。
臨床前實驗提示,艾美賽珠單抗與rFVIIa或FVIII聯合給藥,可能引起血液高凝狀態。艾美賽珠單抗可增強凝血功能,因此治療出血所需的凝血因子劑量可能低於未使用艾美賽珠單抗預防時的劑量。
【包裝】
1瓶/盒
【藥物分類】
酶類,其他治療用藥